上海免疫与感染研究所Nat. Com.|陈昌斌研究组合作揭示白念珠菌毒素的细胞内靶点CCNH蛋白
文章来源:上海免疫与感染研究所 | 发布时间:2024-03-08 | 【打印】 【关闭】
2月27日,中国科学院上海免疫与感染研究所陈昌斌研究组与上海交通大学公共卫生学院单细胞组学与疾病研究中心刘宁宁和王慧团队合作,在Nature Communications上发表了题为“Global fungal-host interactome mapping identifies host targets of candidalysin”的研究论文,首次绘制真菌-宿主相互作用组图谱识别白念珠菌毒素的人体靶标,并验证和阐明了白念珠菌毒素与细胞周期蛋白H(CCNH)的直接相互作用及机制。该研究为深入研究真菌感染致病机制提供了新线索,为抗真菌药物研发提供了新靶点。

机会性致病真菌白念珠菌与人体健康密切相关,据估计,75%的女性在一生中至少会感染一次阴道念珠菌病。白念珠菌的形态转变已经被证明是致病的关键因素,并且为白念珠菌侵袭人体各种组织和逃避宿主防御机制提供巨大优势。ECE1基因在菌丝态白念珠菌细胞内高度表达,编码Ece1蛋白,该蛋白对上皮细胞激活、粘膜损伤及发病机制的影响举足轻重。Ece1蛋白具有七个KR处理位点,通过该位点的裂解产生八个短肽段,分别命名为Ece1-I 到Ece1-VIII,其中只有Ece1-III(白念珠菌毒素)被证明具有溶细胞毒性。当肠道黏膜定植的白念珠菌在肠道上皮易位时,可能会导致致命的系统性血液感染,院内患者抗生素治疗、免疫功能障碍或肠道损伤(如外科手术期间)都可能导致这种结果的发生,在此过程中,ECE1基因介导的菌丝伸长、生物膜形成以及白念珠菌毒素的分泌至关重要。因此,深入研究Ece1短肽段,尤其是白念珠菌毒素在人体中的关键靶基因或受体,寻找介导其发挥生物学效应的信号通路,是急需解决的关键科学问题。
研究通过高通量增强酵母双杂交技术(HT-eY2H)筛选八个Ece1短肽段的人类相互作用蛋白,并绘制了相互作用组图谱,确定了一系列潜在的Ece1短肽段相互作用蛋白,并证明部分蛋白可与多个Ece1短肽段相互作用(图1)。其中,结合生物信息学分析与细胞周期实验结果,研究人员筛选得到白念珠菌毒素的直接相互作用蛋白CCNH,并通过免疫共沉淀实验(Co-IP)、双分子荧光互补实验(BiFC)、表面等离子共振技术(BIAcore)等进一步验证了白念珠菌毒素与CCNH蛋白的直接相互作用,并通过HPepDock技术预测了相互作用结构。在相关机制方面,细胞实验γ-H2AX的表达以及CCNH和γ-H2AX在细胞内的共定位表明,白念珠菌毒素会导致DNA双链断裂(DSB)显著增加,并且白念珠菌毒素与CCNH直接结合激活CDK 激活激酶,从而抑制DNA损伤修复途径;通过口咽念珠菌病小鼠模型,研究发现,白念珠菌毒素敲除的白念珠菌菌株不会刺激CCNH基因上调并诱导DNA双链断裂。简而言之,该研究表明,白念珠菌分泌的白念珠菌毒素通过上调CCNH表达并直接与CCNH蛋白相互作用,诱导DNA损伤促进真菌感染。
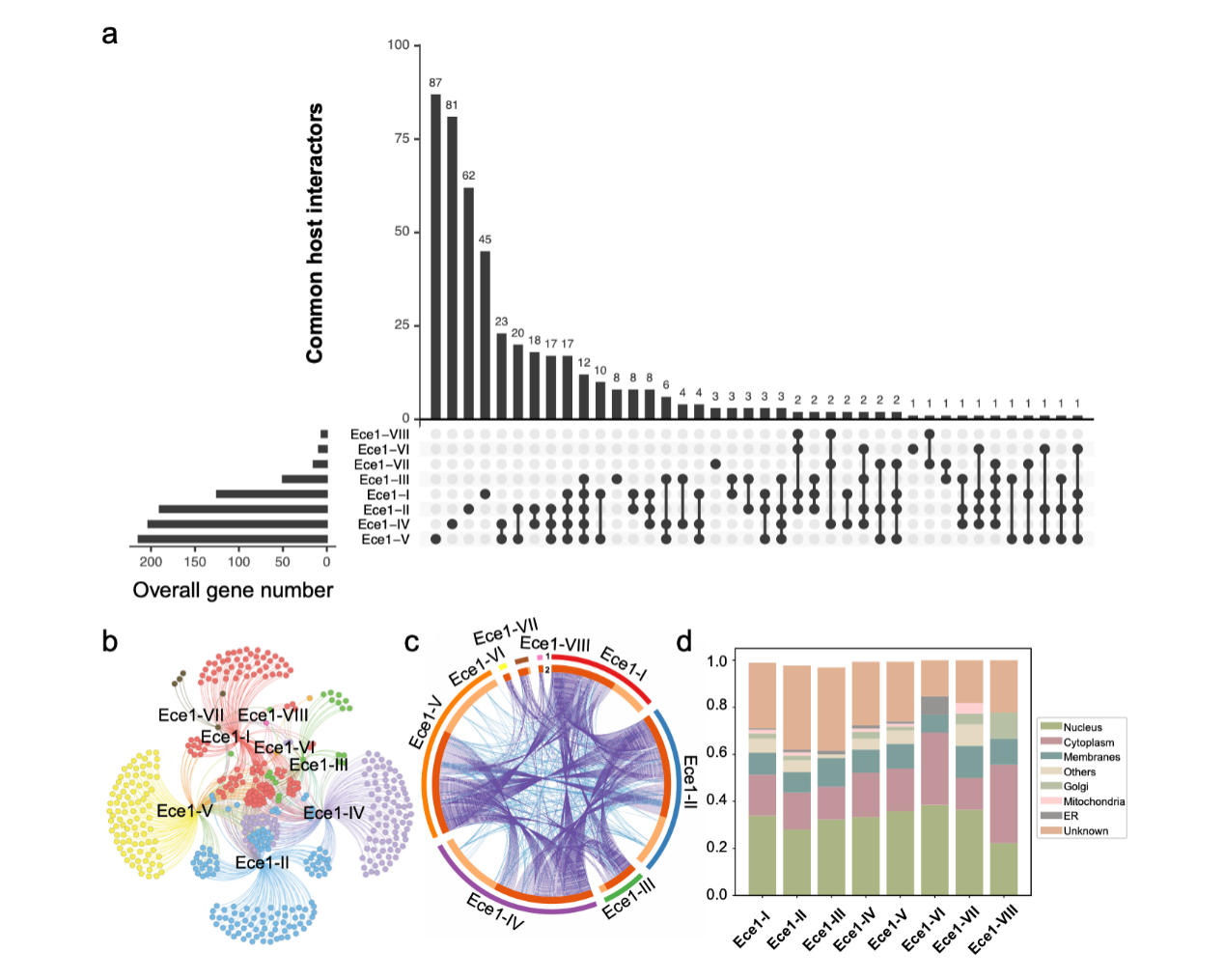
图1 (a)Ece1 蛋白八个肽段的特有相互作用基因、共有相互作用基因示意图;(b)人类靶基因与 Ece1 肽段互作网络分析;(c)Ece1 肽段与人类互作基因及其功能重叠可视图;(d)Ece1肽段的人类相互作用基因细胞内定位情况
中国科学院上海免疫与感染研究所陈昌斌研究员,上海交通大学公共卫生学院单细胞组学与疾病研究中心刘宁宁研究员和王慧教授为本研究的共同通讯作者,该研究得到了同济大学生物信息系朱瑞新教授、上海交通大学医学院张健教授、中国科学院上海免疫与感染研究所潘磊教授、上海交通大学公共卫生学院栾洋教授的大力支持和帮助,同时得到了科技部国家重点研发计划、国家自然科学基金委、上海市科委、上海市教委、上海高水平地方高校创新团队等项目资助。
原文链接:https://doi.org/10.1038/s41467-024-46141-x
