Cell Res | 上海药物所揭示琥珀酸受体配体识别和激活的结构基础
文章来源:上海药物研究所 | 发布时间:2024-06-06 | 【打印】 【关闭】
2024年6月4日,中国科学院上海药物研究所徐华强团队联合复旦大学付伟团队,在Cell Research上发表了题为“Molecular basis of ligand recognition and activation of the human succinate receptor SUCR1”的最新研究成果,报道了人源SUCR1独特的配体结合特征和激活机制,为开发新型靶向SUCR1的化合物奠定了基础。

图1. 文章在线发表页面。
以往研究发现,琥珀酸不仅是三羧酸循环重要的中间产物,其在调控线粒体氧化应激的稳态中扮演着重要角色,而这一功能主要是通过G蛋白偶联受体家族中的重要成员SUCR1介导。 SUCR1也被称为GPR91,2004年发表在Nature的一篇文章证实了琥珀酸是它的内源性配体。后续十几年的研究发现,该受体的激活与肝纤维化、高血压和类风湿性关节炎等密切相关。因此,深入研究SUCR1的配体识别机制和激活机制,对于理解其生理功能并开发靶向SUCR1的药物具有重要意义。
本项研究中,研究人员利用单颗粒冷冻电镜技术,分别解析了SUCR1被琥珀酸、马来酸及compound 31激活,并偶联下游G蛋白复合物的结构,分辨率分别为2.75埃,2.69埃和2.48埃(图2a)。结构分析发现,在琥珀酸和SUCR1的复合物结构中,琥珀酸两端亲水性的羧基和Y301.39、Y832.64形成氢键,和R993.29、R2817.39形成离子键,而中间烷基的部分和周围氨基酸形成疏水相互作用。将结合口袋中关键的残基如Y301.39、L792.60、Y832.64、R993.29、R2817.39、L1023.32等突变成丙氨酸均明显降低了配体的活性,证实了它们在琥珀酸结合和受体活化中的重要作用。马来酸和琥珀酸结构相似,它们在SUCR1的结合口袋也非常相似(图2c-f)。compound 31是一种人工合成的高效SUCR1激动剂。在compound 31和SUCR1的复合物结构中,研究人员发现了两个结合口袋。compound 31的“琥珀酸”部分和琥珀酸、马来酸的结合口袋几乎一致,而“双环”部分使R993.29的侧链发生偏转,然后延伸到一个新的口袋中,这种独特的结合模式可能是compound 31和琥珀酸、马来酸相比更能有效激活SUCR1的原因。关键氨基酸残基的功能突变,如Y301.39A、L792.60A、N983.29A等,能明显减弱配体的激活效应(图2g-j),表明这些相互作用对于配体识别的重要作用。
三种复合物的整体构象较为相似,均捕捉到了SUCR1的激活构象—胞内端TM6外移而TM7内移,形成与Gi蛋白C末端α5螺旋交互的空腔,体现了SUCR1与Gi蛋白偶联的经典GPCR活化模式(图2k-m)。活化过程中,配体和疏水残基L1023.32、F2857.43形成疏水相互作用,推动F2857.43下移并与L1063.36、F2456.48等残基紧密作用,最终引发TM6的整体外移,从而完成SUCR1受体活化过程(图2n)。以上结果系统阐释了SUCR1的活化机制,并揭示了其与不同配体分子结合的微观细节,为开发新型靶向SUCR1的化合物奠定了基础。
本研究中的冷冻电镜数据由上海药物所高峰电镜中心收集。上海药物所、上海科技大学和临港实验室联合培养博士研究生李昌耀、上海药物所博士后刘恒和南京中医药大学硕士研究生李静茹为该论文的共同第一作者。上海药物所徐华强研究员和复旦大学付伟教授为共同通讯作者,上海药物所为第一完成单位。该工作获得了包括上海市市级科技重大专项、国家自然科学基金委、国家重大科技专项、国家重点基础研究计划等经费的资助。
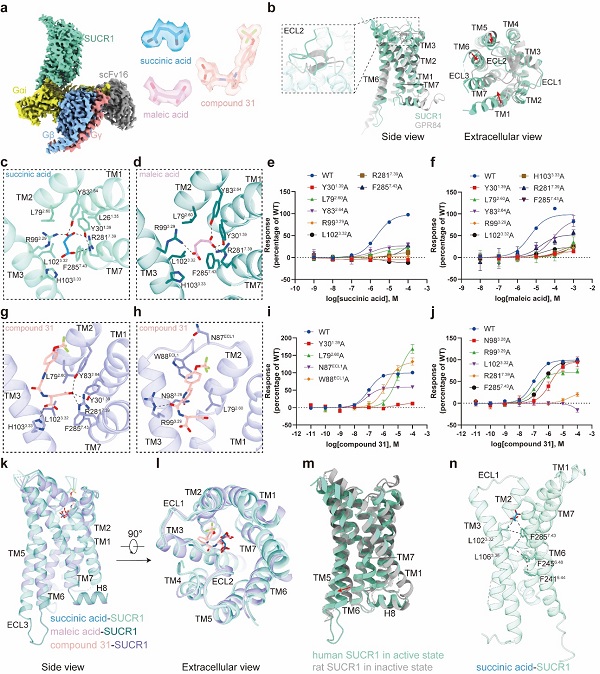
图2. SUCR1分别结合内源性配体琥珀酸、马来酸,以及外源性配体compound 31,和Gi蛋白复合物的冷冻电镜结构和分子基础。a. SUCR1的G蛋白冷冻电镜结构;b. SUCR1和GPR84的结构比较;c-l. SUCR1的配体识别机制;m-n. SUCR1的激活机制。
文章链接:https://www.nature.com/articles/s41422-024-00984-7
