9月10日,国际学术期刊Nature在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)韩硕研究员团队的最新研究成果,题为:“Amplifying antigen-induced cellular responses with proximity labelling”。 该研究报道了一种全新的肿瘤免疫治疗策略,核心在于通过邻近标记技术在靶细胞表面原位、高密度地构建人工抗原簇。该研究使用一种红光或超声波响应激活的工程化纳米酶(PCN),能够在肿瘤细胞表面催化含有人工抗原FITC的探针与邻近蛋白质共价反应,实现对靶抗原的扩增(PATCH),从而创造性地解决了免疫治疗中抗原密度不足和特异性差的瓶颈问题。
肿瘤免疫治疗,特别是那些旨在利用T细胞来识别和清除癌细胞的疗法,已成为癌症治疗领域的一大突破。然而,其广泛应用仍面临两大瓶颈:许多肿瘤相关抗原在癌细胞表面的表达密度不足,难以有效激活T细胞;同时,这些抗原也常常在正常组织中有低水平表达,导致治疗的特异性差,可能引发脱靶的毒副作用。因此,开发能够增强抗原信号、并精准靶向肿瘤细胞的新策略至关重要。
围绕这一核心难题,研究团队从化学生物学的角度出发,创新性地思考:能否将一种用于“检测”蛋白质空间关系的“邻近标记技术”转化为一种“功能调控工具”,直接在肿瘤细胞表面对靶向信号进行“扩增”,从而“标记”出需要被免疫系统攻击的细胞。
在该研究中,研究人员首次将邻近标记技术应用于免疫功能调控,开发了一种全新的细胞表面蛋白工程化策略(Proximity Amplification and Tagging of Cytotoxic Haptens,PATCH)。该策略的核心是一种可通过红光或超声响应激活的工程化纳米酶(PCN)。研究人员首先将这种纳米酶靶向递送至肿瘤细胞表面,随后通过外部的红光或超声进行精准、无创的局部激活。被激活的纳米酶会催化含有人工抗原(FITC)的探针分子,使其与纳米酶周围数纳米范围内的细胞表面蛋白发生快速、大量的共价连接。这一过程如同在靶细胞表面“种下”了高密度的人工抗原簇。
这种原位构建的高密度抗原簇成为免疫细胞的“超级信标”。通过一种可同时结合FITC和T细胞表面CD3分子的双特异性T细胞衔接器(BiTE),这些抗原簇能够高效地招募并聚集T细胞受体(TCR),从而强力激活T细胞,极大地增强了其对肿瘤细胞的识别和杀伤效力。
该策略在多种实体瘤动物模型和临床来源的肿瘤样本中均取得了突破性的治疗效果。研究显示,PATCH疗法不仅能够完全清除经过治疗的肿瘤,更重要的是,其高效的肿瘤杀伤过程会释放大量肿瘤抗原,进一步激发机体产生针对远端未治疗肿瘤的系统性免疫反应(即“远端效应”),并形成长效的免疫记忆,从而有效防止肿瘤复发。
该研究首次将邻近标记反应从一种分子互作的“检测工具”拓展为一种强大的“功能调控工具”。其核心优势在于通过催化扩增反应解决了天然抗原密度不足的问题,并通过物理手段(光或超声)的精准控制保证了治疗的高度特异性,极大地拓宽了肿瘤免疫治疗的靶点选择范围。这项工作为开发精准、高效、低毒的下一代免疫疗法提供了全新的思路和平台。
分子细胞卓越中心韩硕研究员和复旦大学附属中山医院高强教授为该论文共同通讯作者。分子细胞卓越中心博士后李烁钧、上海交通大学博士生门盈辉、分子细胞卓越中心博士生王子涵、复旦大学医学院博士生吴英成为该论文共同第一作者。该工作得到分子细胞卓越中心的许琛琦研究员、王广川研究员、中国科学院上海药物研究所周虎研究员、复旦大学附属中山医院樊嘉教授、分子细胞卓越中心实验动物技术平台和细胞分析技术平台、中国科学院分子植物科学卓越创新中心质谱平台、华中农业大学等大力支持。该工作获国家重点研发计划、中国科学院战略性先导科研专项、国家自然科学基金、上海市科技重大专项、以及国家科技重大专项、中国博士后科学基金资助。
文章链接:https://www.nature.com/articles/s41586-025-09518-6
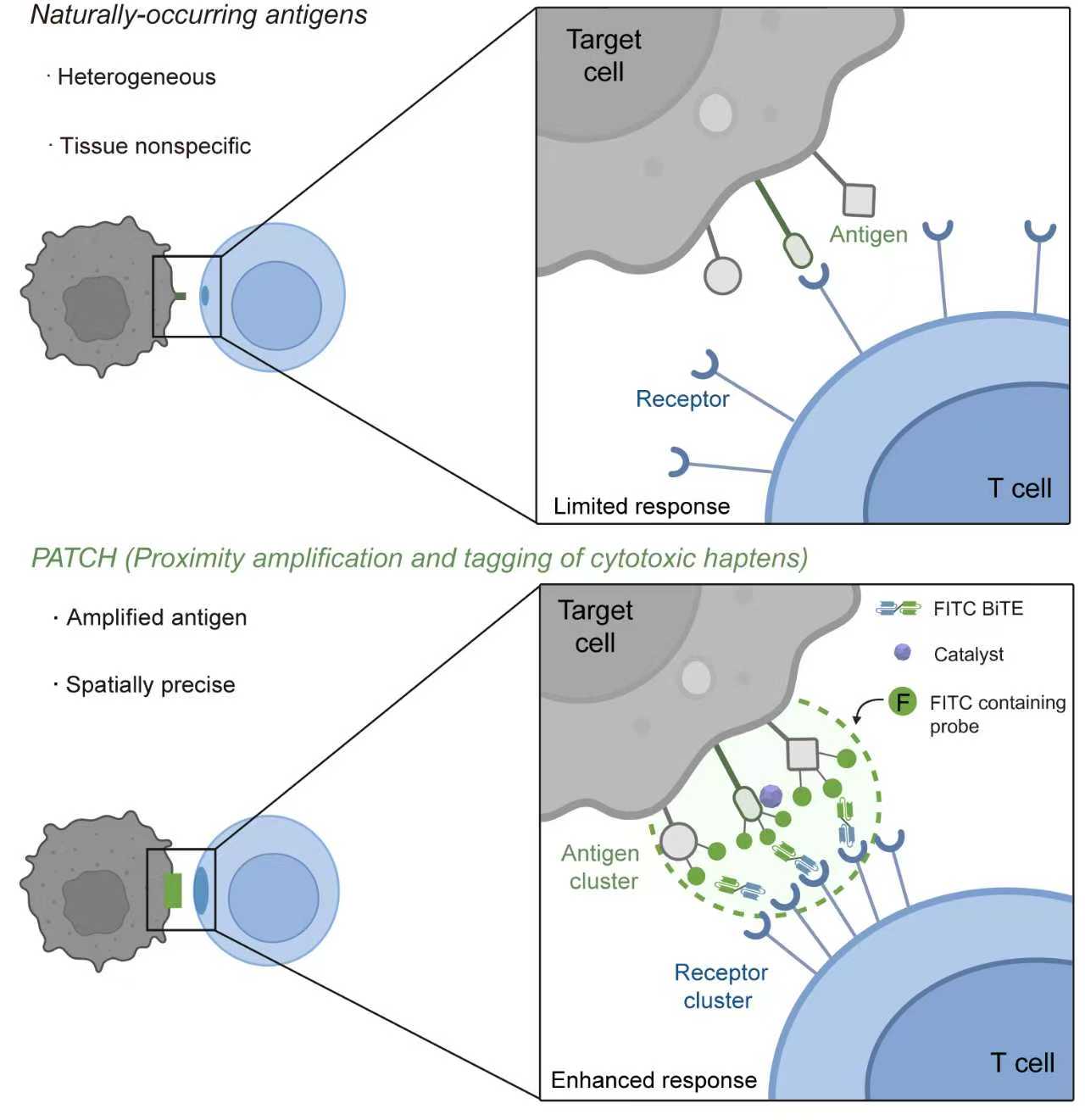
基于邻近标记的抗原扩增技术(PATCH)示意图

